거세/단미 조직액을 활용한 PRRS 바이러스 안정화 모니터링
작성자 정보
- 닥터스와인 작성
- 작성일
컨텐츠 정보
- 4,212 조회
- 목록
본문
4-1. 거세/단미 조직액을 활용한 PRRS 바이러스 안정화 모니터링 |
현재 번식 돈군에서 PRRSV 모니터링 방법은 30일 간격으로 포유자돈(이유 전 7일 ~ 이유 후 3일) 30두의 혈액 샘플을 가지고 항원 검사를 진행하는것이다. 결과적으로 4번 연속 항원 음성일때 안정화 상태라고 정의할 수 있다.
이 모니터링 방법은 90일 동안 10% 미만의 유병율 상황에서 PRRS 바이러스가 번식돈군에 남아 있을 수 없다는 가정을 전제로 하고 있다. 그러나 안정화 직후 PRRSV가 진단되는 번식돈군의 케이스들이 보고되고 있기 때문에 개선된 모니터링 체계가 필요하다.
현재 모니터링 방법은 검사 빈도수와 두수를 증가시킴으로써 개선할 수 있지만 혈액 샘플링은 시간 소모와 노동력이 크고 자돈들의 스트레스를 증가시킨다. 따라서 실용적이고 경제적인 모니터링 방법이 필요한 시점이다.
집단 샘플인 구강액의 경우 2010년 양돈 산업에 도입되어 모니터링과 검사를 위해 광범위하게 사용되고 있다. 그러나 포유자돈의 구강액 채취는 쉽지 않다. 대안이 되는 방법으로 거세/단미 조직액(processing fluid)을 활용할 수 있다.
따라서 이번 주제에서는 거세/단미 조직액 샘플링 방법과 혈액 샘플일 대신할 수 있는지에 대한 실험 결과들을 공유하겠다.
1. 거세/단미 조직액의 정의와 샘플링 방법
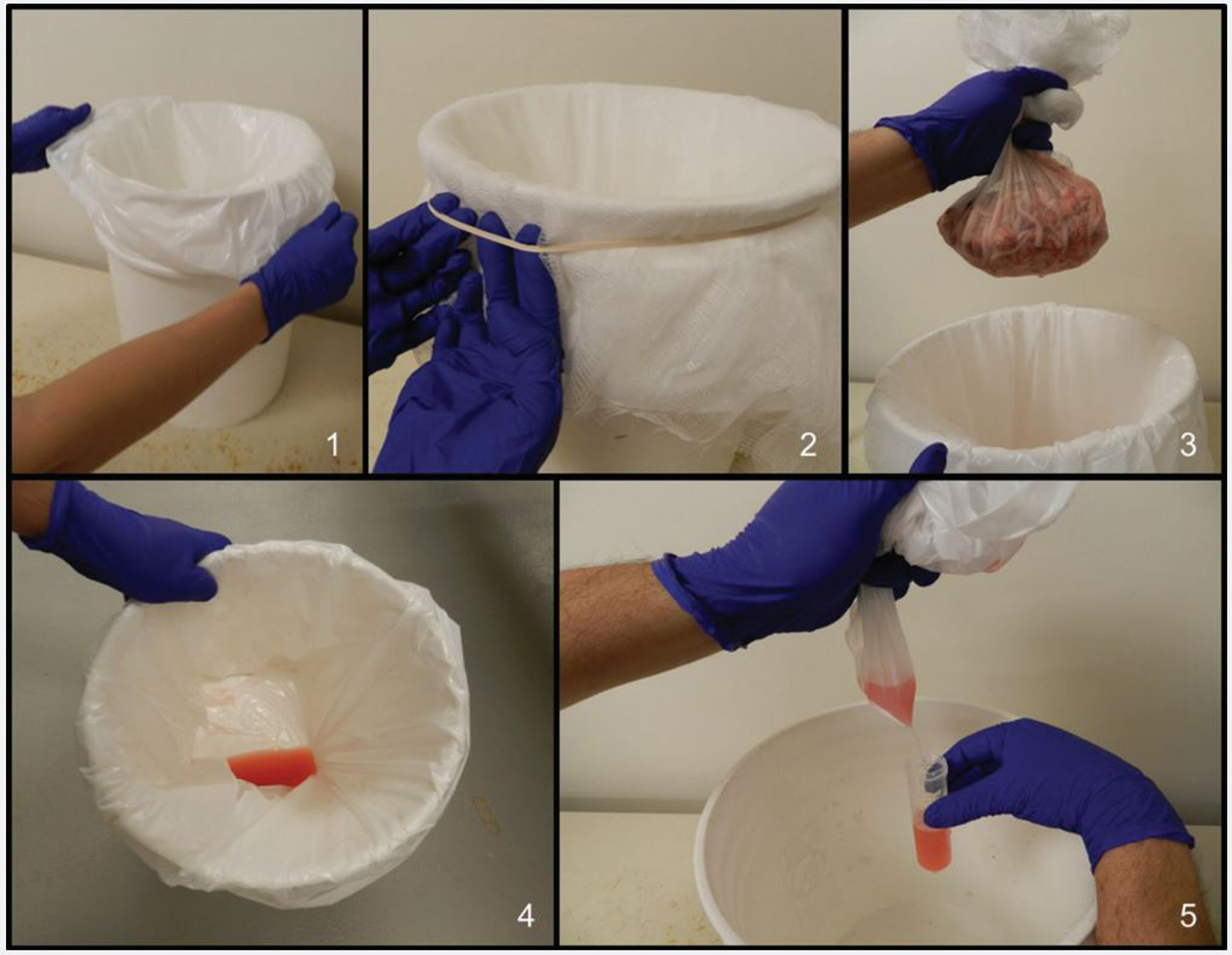
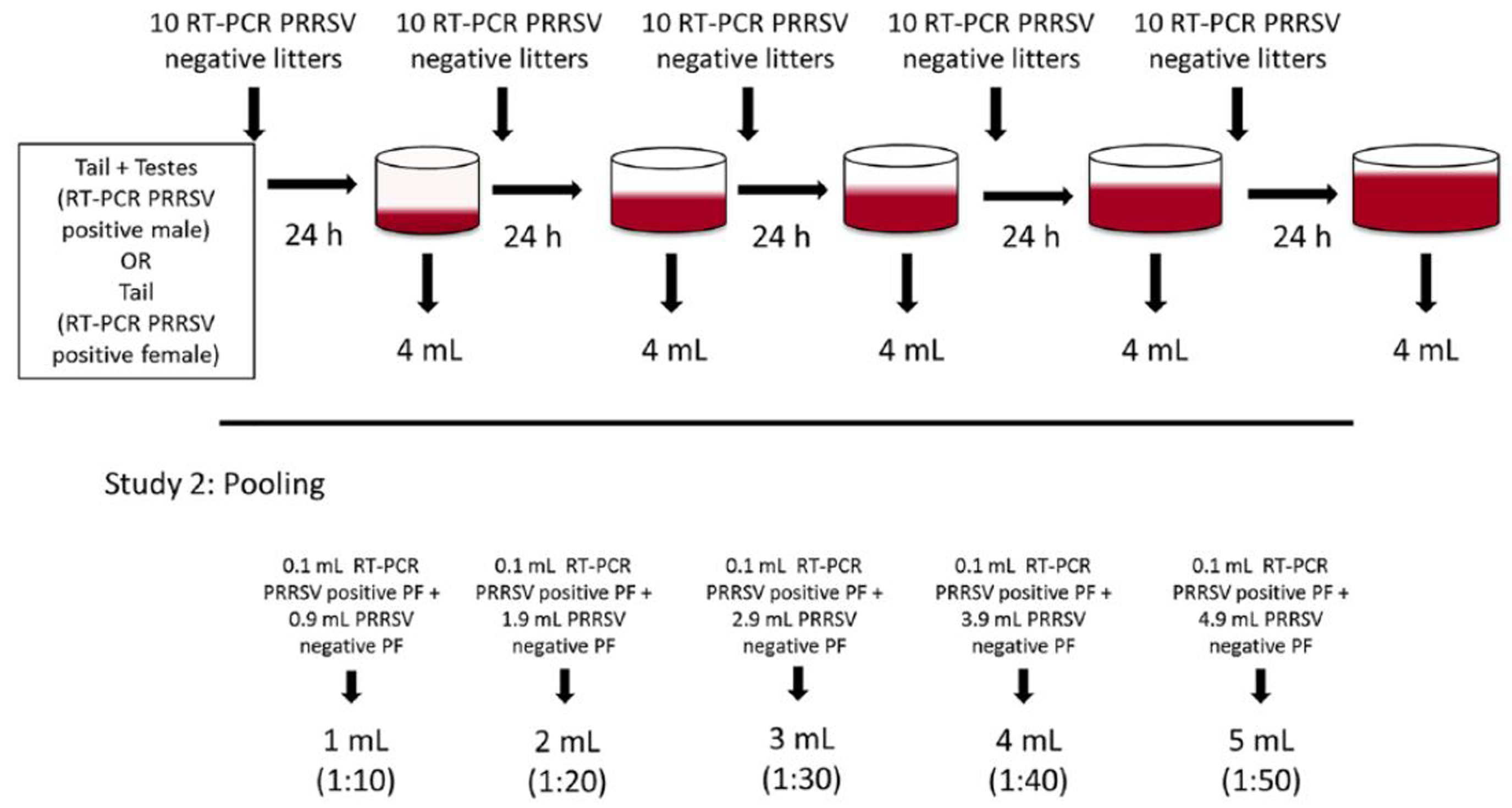
거세/단미 조직액(processing fluids, PF)은 포유자돈의 거세와 단미로부터 얻어진 장액혈액성 액체이다. PF 샘플링 방법은 다음과 같다 (그림 1).
먼저 깨끗한 플라스틱 통 입구를 일회용 비닐로 감싸고 벗겨지지 않도록 고무줄을 덮어준다. 다음으로 포유자돈의 거세와 단미를 실행하고 조직들을 다른 일회용 비닐에 보관하고 조그마한 구멍을 뚫어 처음 준비한 플리스틱 통에 PF를 모은다. 마지막으로 모아진 PF를 멸균된 50ml 코니칼 튜브에 옮긴다.
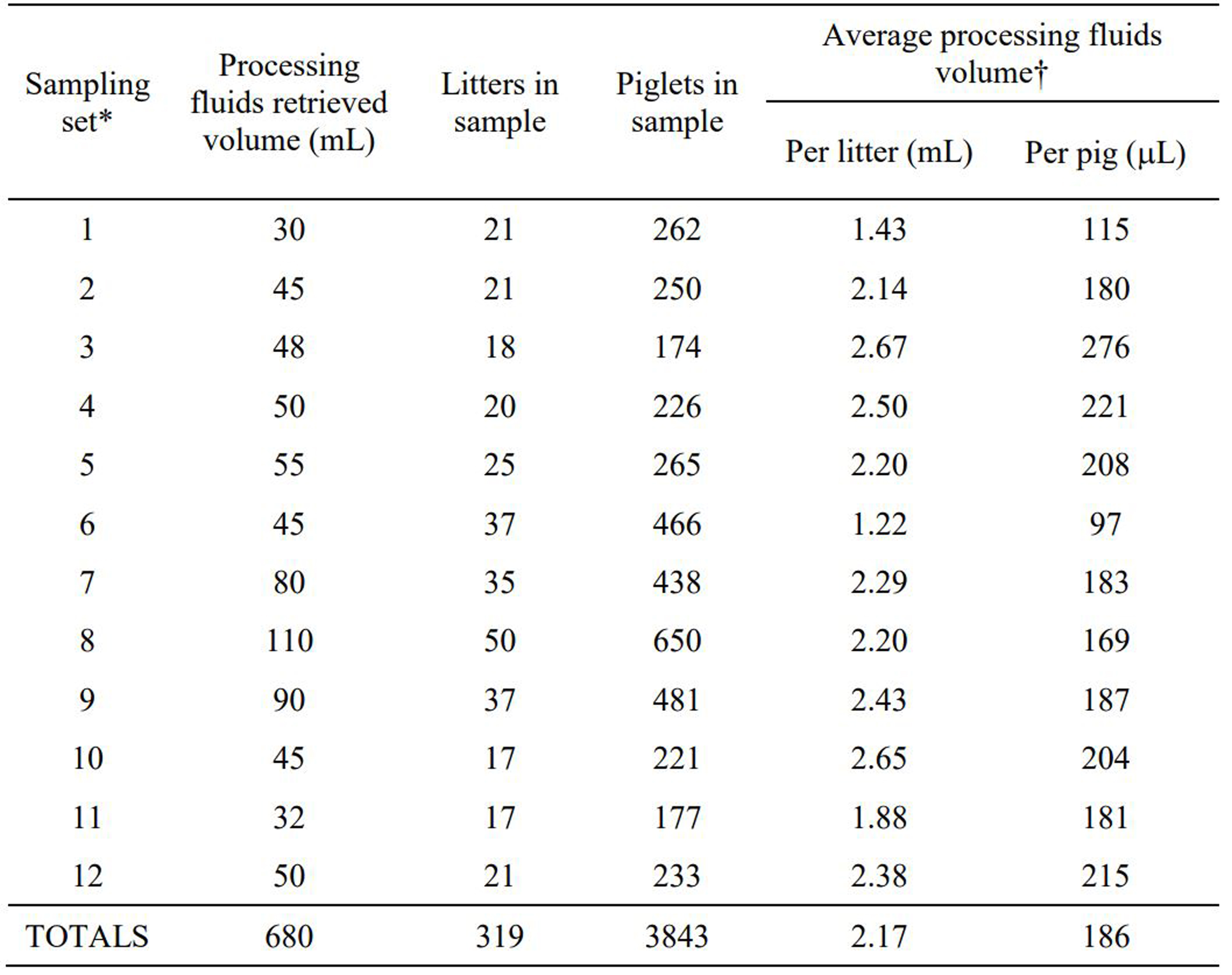
3~5일령 포유자돈 256두(174~650)의 거세/단미 조직액 양은 49.0ml (30.0 ~ 110.0)를 기록했다. 복당 그리고 자돈 두당 평균 거세/단미 조직액 양은 각각 2.17ml (1.22 ~ 2.67)와 0.186ml (0.098 ~ 0.276)를 기록했다 (표 1).
2. 거세/단미 조직액(PF) 1개 vs 혈액(Serum) 30개 PRRSV 항원 양성률 비교
* 27주 이내 PRRS 임상 증상을 경험한 번식농장 4곳에서 PF vs Serum
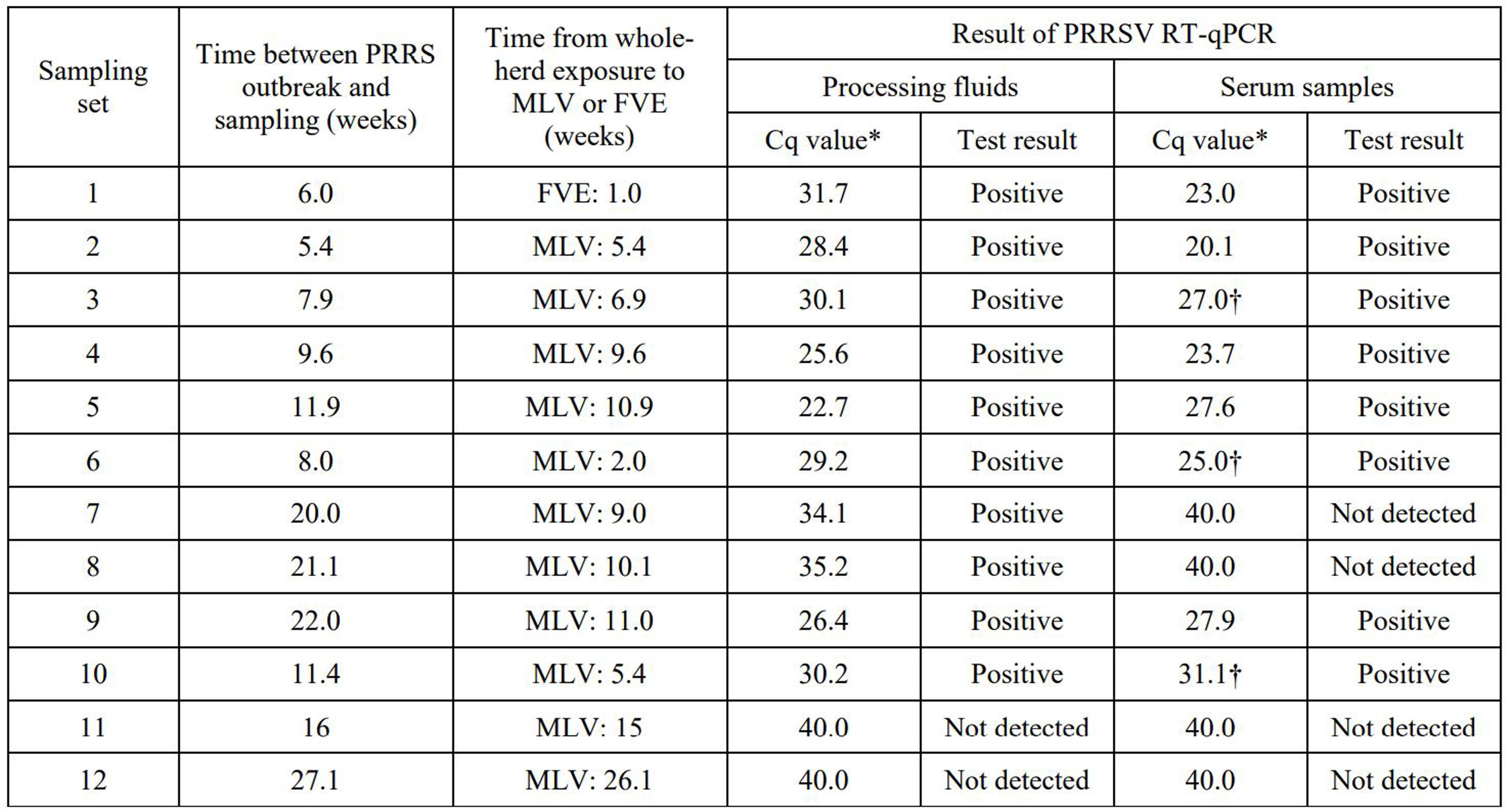
27주 이내 PRRS 임상 증상이 있었던 번식농장(교배~이유) 4곳을 대상으로 거세/단미 조직액과 혈액 샘플들의 항원 검사 결과(RT-qPCR) Ct 값이 37 미만은 양성, 37 이상은 음성으로 판정했다.
실험 결과 거세/단미 조직액은 83.33% (10/12), 매칭 혈액 샘플들은 66.66% (8/12)의 항원 양성 결과를 보였다 (표 2). 매칭 혈액 샘플들의 경우 5개씩 풀링된 6개 샘플들 중 최소 1개 이상 양성일 경우 양성으로 판정했다. 전체 72개의 풀링된 샘플들의 항원 양성률은 15.27% (11/72)를 기록했다.
* PRRSV 양성인 번식 농장 2곳에서 77복을 대상으로 PF vs Serum
미국 중서부에 위치한 주간관리 번식 농장(교배-이유) 2곳을 대상으로 실험을 진행했다. 농장 1곳은 모돈 1,750두 규모이며 PRRS 컨트롤과 제거 프로그램으로'load-close-expose'을 적용했고 실험 시작 4주전 바이러스혈증이 있는 혈청을 모돈 모돈들에게 접종했다. 나머지 1곳은 이전 3개월 동안 PRRSV 음성과 임상 증상이 없는 모돈 6,000두 규모의 PRRSV 안정화 농장이다.
이 실험의 목적은 거세/단미 조직액 샘플들과 바이러스혈증 상태의 자돈들 사이의 항원 진단 결과를 비교하는것이다. 전체 77복으로부터 개체별 혈청 834개, 거세/단미액 77개를 샘플링하고 항원 검사를 진행했다.
77복 중 55복(71.4%)은 바이러스혈증(혈액 양성) 상태의 자돈을 포함하지 않았고 거세/단미 조직액도 음성으로 나타났다. 나머지 22복(28.6%) 중 10복은 1두씩 혈액 양성 자돈을 포함했고 이 그룹의 10개 거세/단미 조직액 중 5개가 항원 양성으로 나타났다 (표 3).
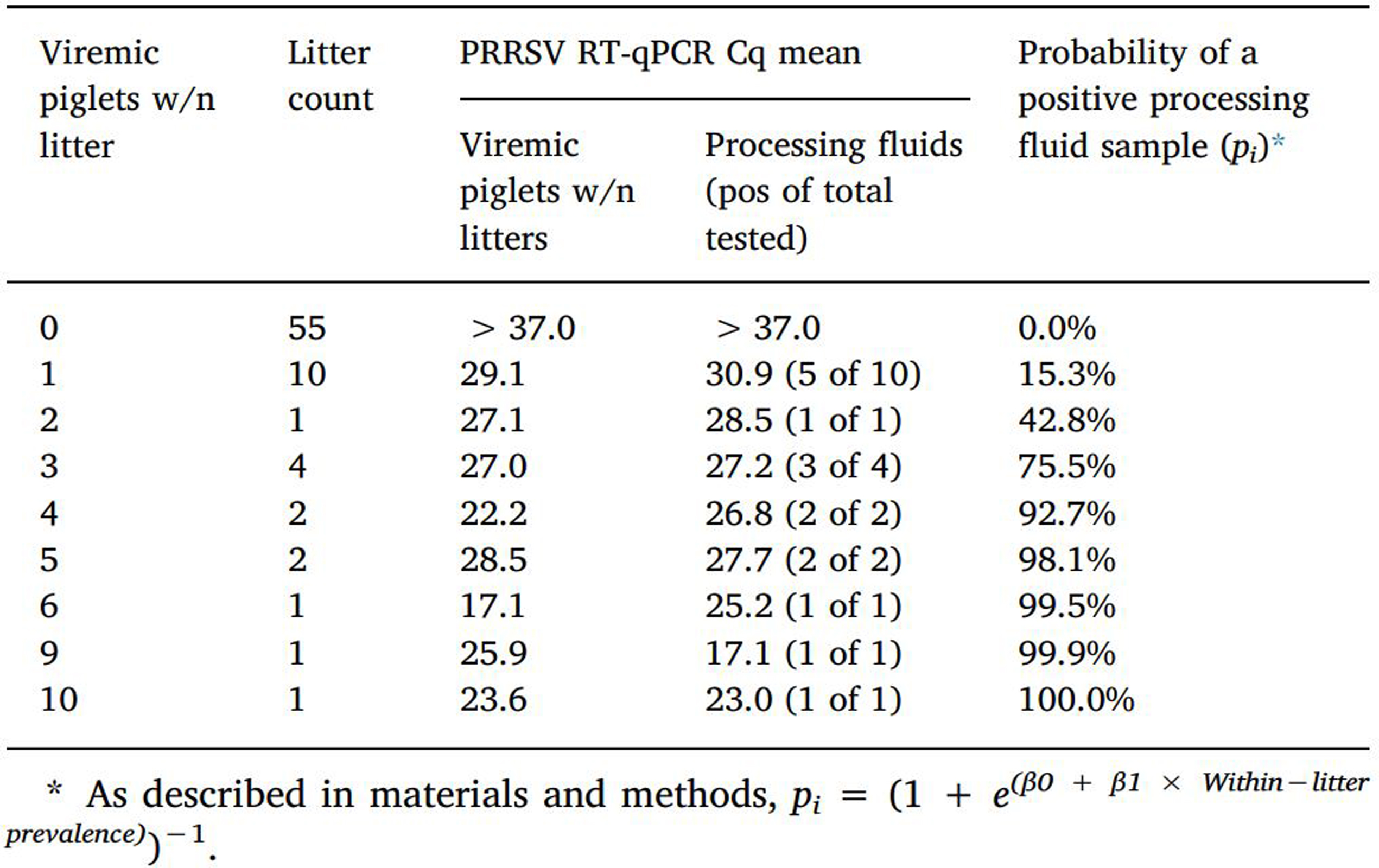
임의로 선택된 자돈들 (복당 1, 2, 3, 또는 4두)의 혈청 샘플들과 비교했을때 거세/단미 조직액 1개에서 PRRSV 항원 진단 가능성은 다음과 같다. 복내 포유자돈들의 혈액 양성률이 39%(50%) 이상일 경우 거세/단미 조직액의 양성률은 95%(99%) 이상으로 매우 높은 진단 가능성을 보여줬다 (그림 2).
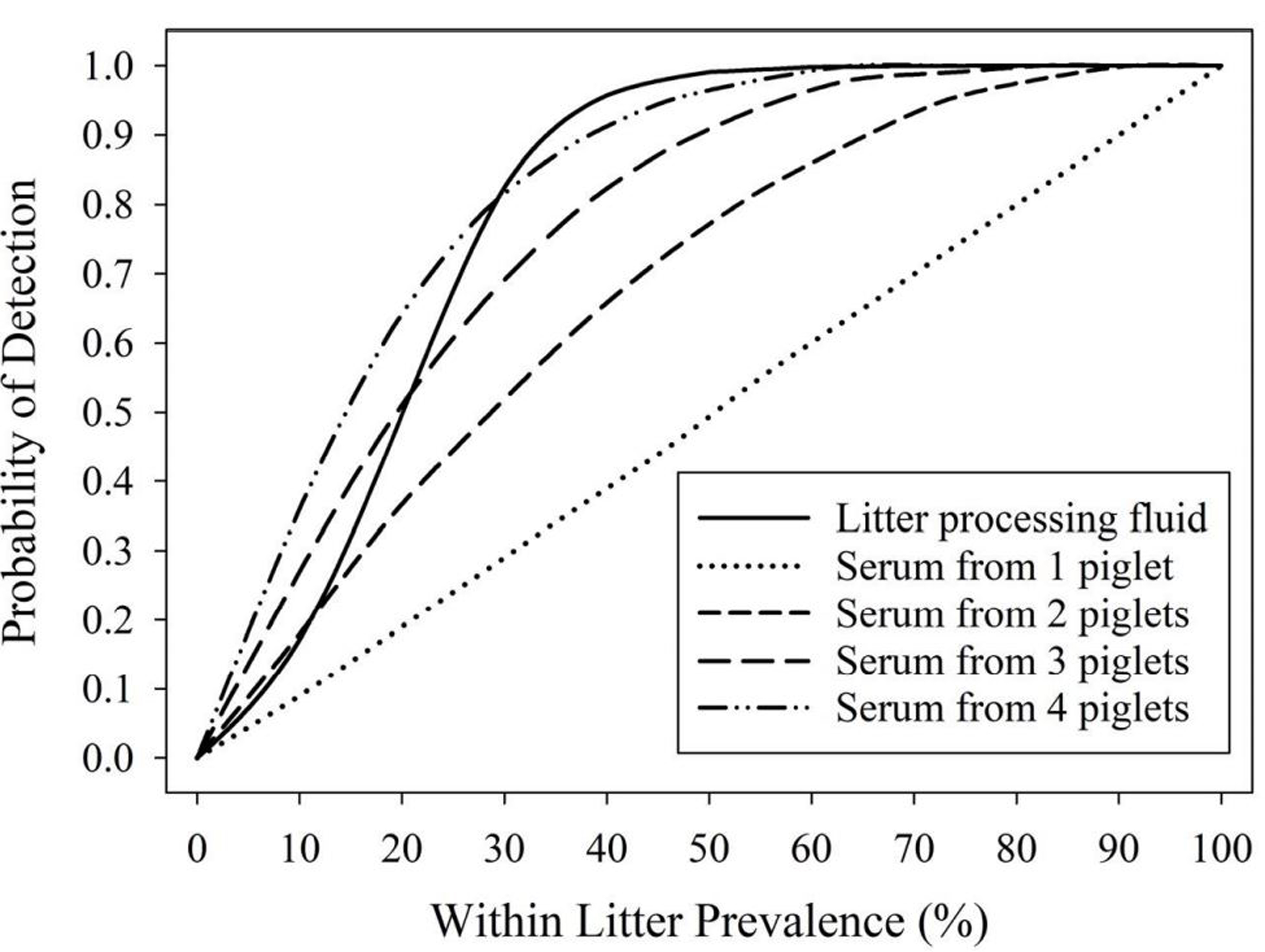
여러복으로부터 풀링한 거세/단미 조직액들은 PRRSV 항원 진단 가능성을 증가시킨다. PRRSV 진단 비용 관점에서 개체별 혈청 샘플 이용시 이유자돈 두당 5.00달러이지만 거세/단미 조직액 이용시 0.086달러로 적은 비용이 소요된다.
PRRSV 돈군 상태를 검사하기 위해 거세/단미 조직액 이용은 적은 비용으로 연속적인 검사가 가능한 실용적이고, 믿을만하며 효과적인 검사 방법이다.
3. 거세/단미 조직액(PF)과 혈액(Serum) 샘플들 항원 검사 일치율
미국 일리노이에 위치한 자돈 생산(교배-이유)의 모돈 6,000두 규모 농장에서 실험을 진행했다. 2015년 4월 PRRSV 감염이 있었고 2016년 6월까지 항원 양성인 이유자돈을 생산했다.
PRRS 바이러스 계획일 설정했고 2017년 1월 잠재적 음성 단계로 접어들었지만 2월 22일 모돈에서 임상 증상과 함께 과거와 동일한 바이러스주(strain)이 진단되었다.
PRRS 발생 후 10일 3주 간격으로 8번 연속 샘플링을 진행했다. 각 샘플링 시점마다 10복의 3일령 자돈(양자 보내기 전)을 대상으로 한복의 모든 자돈들 혈액과 거세/단미 조직액을 채취했다.
실험 결과 77복 중 23복(29.8%)의 거세/단미 조직액과 혈청 샘플들에서 항원 양성으로 나타났다. 두 샘플들 사이의 PCR 결과 일치율은 92.21%, Cohen's kappa는 0.81 (95% 신뢰도: 0.59-1.00)을 기록했다. 혈청에서 항원검사 결과와 비교했을때 거세/단미 조직액의 상대적인 항원 민감도는 87% (95% 신뢰도: 66-97%), 특이도는 94% (95% 신뢰도: 85-99%)를 기록했다(표 4).
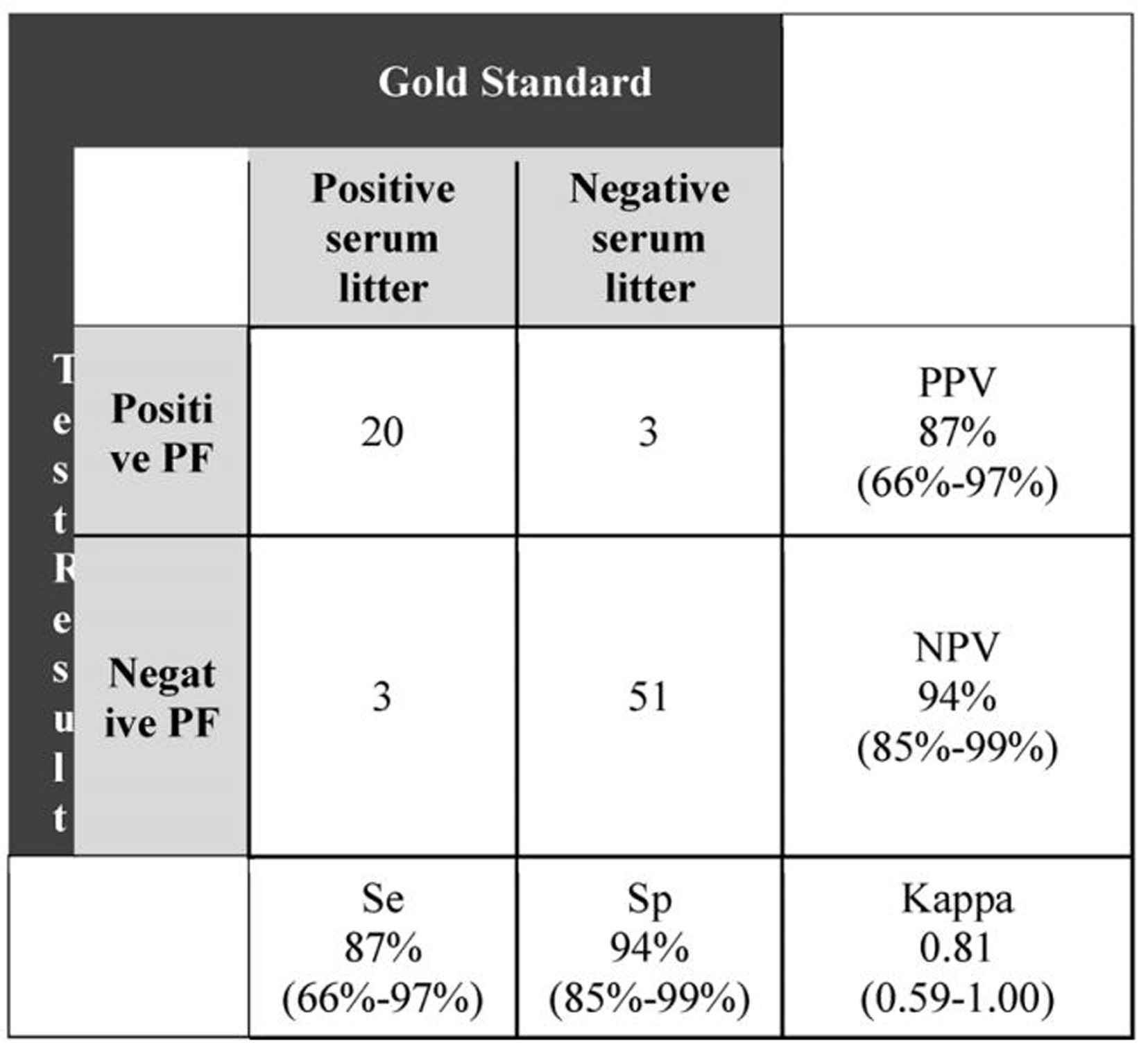
4. 거세/단미 조직액을 활용하기 위한 세부 조건(허용 분만 복수, 검사 횟수)
2번과 3번 항목에서 PRRSV 안정화 확인을 위해 혈청 샘플 대신 거세/단미 조직액을 활용할 수 있다는점을 확인했다. 그렇다면 민감도를 높이기 위한 조건은 어떻게 될까? 여기서는 민감도를 높이기 위한 2가지 사항을 알아보겠다.
* 거세/단미 조직액 PCR결과가 얼마만큼 연속으로 음성으로 나와야 하는가?
혈액 샘플의 경우 포유자돈(이유 전 7일 ~ 이유 후 3일)을 항원 검사해서 30일 간격 4번 연속 음성 결과를 보일때 안정화 상태로 평가할 수 있다. 그렇다면 거세/단미 조직액의 기준은 무엇일까?
그림 3을 참고하면 거세/단미 조직액은 양성-음성-양성 결과가 반복될 수 있다.
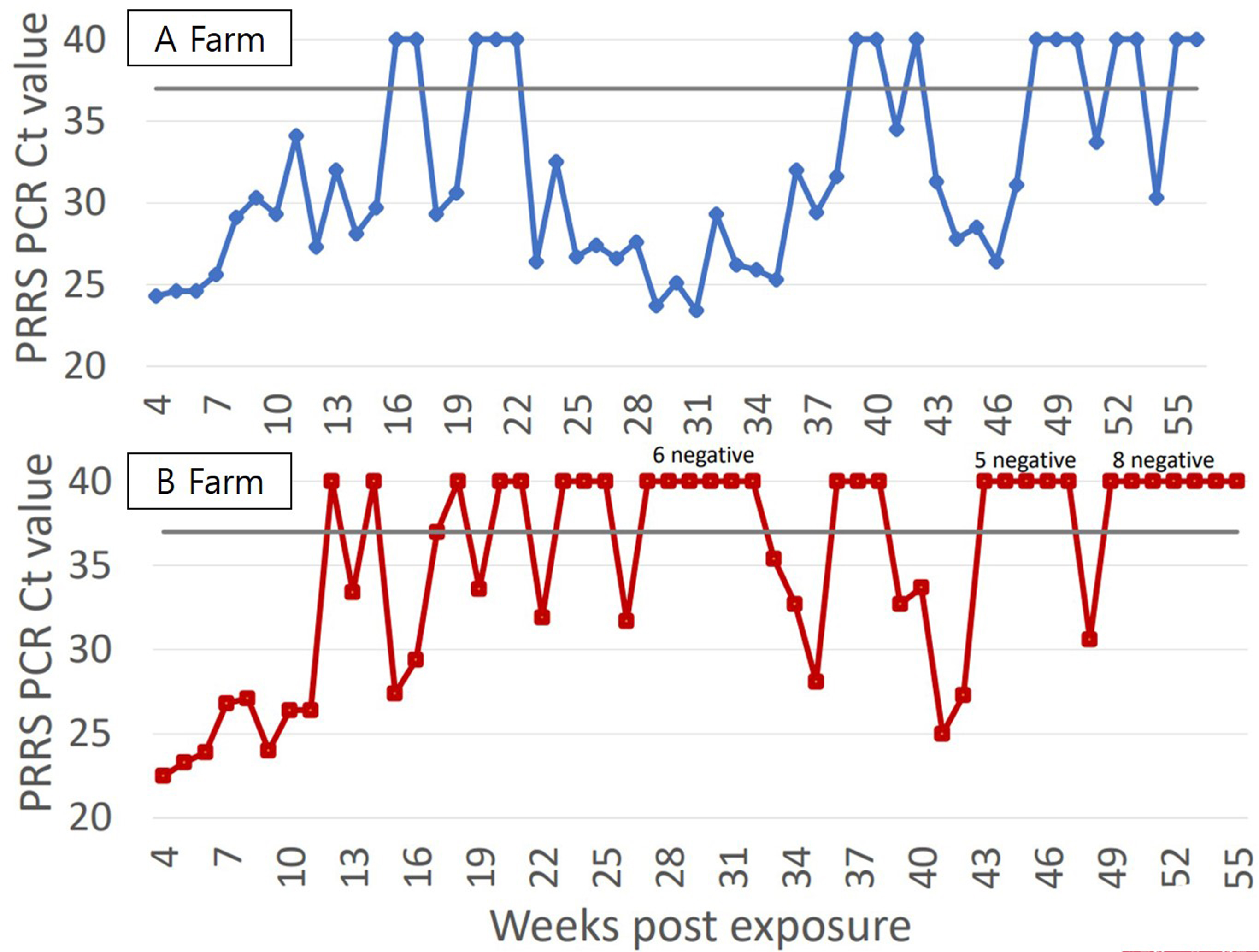
결론적으로 주차별 3~5일령 거세/단미 조직액 항원 검사 결과가 최소 8번 연속 음성으로 판정될 때 다음번 검사에서 양성일 가능성은 제로 '0'가 된다 (그림 4).
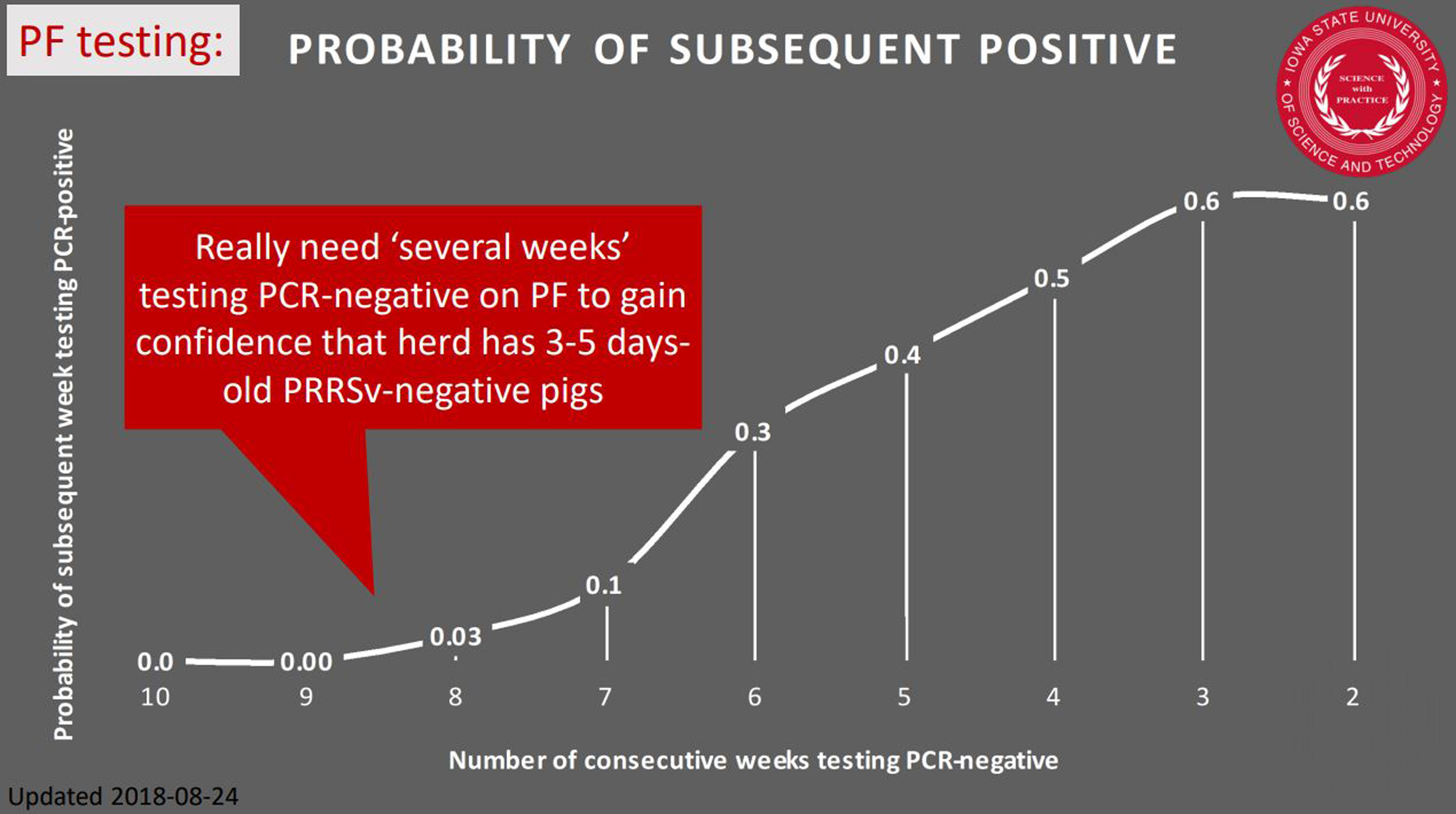
* 거세/단미 조직액 얼마의 복단위 또는 자돈두수까지 풀링해서 검사가 가능한가?
혈액 샘플의 경우 포유자돈(이유 전 7일 ~ 이유 후 3일) 30두를 항원 검사할때 5두씩 풀링해서 진행한다. 그렇다면 거세/단미 조직액은 몇두까지 풀링 가능할까?
각 선택된 항원 양성인 거세/단미 조직액은 항원 음성인 거세/단미 조직액을 이용해서 10배, 20배, 30배, 40배 그리고 50배 희석한 뒤, 희석 샘플을 다시 한번 항원 검사를 진행했다 (그림 5).
희석 샘플을 다시 항원 검사 했을때 Ct value는 10배 희석 후 최초 Ct value로부터 4.6 ± 0.7 Ct (mean ± SD) 증가했고 10배와 50배 희석 샘플 사이의 평균 증가는 1.4 ± 0.9 Ct로 나타났다.
항원 양성(Ct ≤ 35) 결과를 나타내는 최대 희석 배수는 샘플의 최초 Ct value에 따라 다양하게 나타난다 (표 5). 예를 들어 최초 Ct value가 20 또는 25인 경우 1,000배 희석까지 항원 양성으로 나타났지만 30인 경우 22배 희석 후 음성으로 나타났다.
즉 최초 Ct value가 20과 25의 경우 풀링은 PCR 진단에 영향을 미치지 않았다. 그러나 최초 Ct value가 30 이상의 경우 풀링의 양을 감소시켜야 한다.
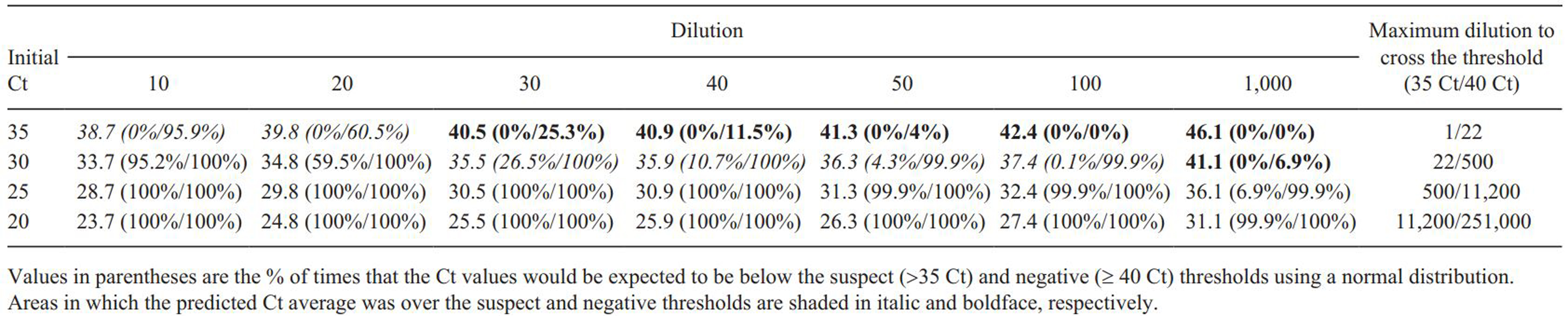
결과적으로 샘플에 존재하는 돼지 1두의 Ct value가 22이하의 경우 적어도 50복, Ct value가 33이하의 경우 40복까지 풀링 가능하다.
5. 참고 문헌
1. Lopez WA, Angulo J, Zimmerman JJ, Linhares DCL. Porcine reproductive and respiratory syndrome monitoring in breeding herds using processing fluids. J Swine Health Prod. 2018;26(3):146-150.
2. Lopez Will Alberto. Strengthening porcine reproductive and respiratory syndrome virus (PRRSV) detection in breeding herds: Development and assessment of processing fluids sampling strategies" (2020). Graduate Theses and Dissertations. 18046. https://lib.dr.iastate.edu/etd/18046
3. Lopze WA, Zimmerman JJ, Gauger PC, Harmon KM, Bradner L, Zhang M, Gimenez-Lirola L, Ramirez A, Cano JP, Linhares DCL. Practical aspects of PRRSV RNA detection in processing fluids collected in commercial swine farms. Prev Vet Med. 2020;180:105021.
4. Vilalta C, Sanhueza J, Alvarez J, Murray D, Torremorell M, Corzo C, Morrison R. Use of processing fluids and serum samples to characterize porcine reproductive and respiratory syndrome virus dynamics in 3 day-old pigs. Vet Microbiol. 2018;225:149-156.
5. Alemida M, Trevisan G, Lopez WA, Linhares DCL. Towards the best testing protocol to classify a farm as PRRS stable. Allen D. Leman Swine Conference, 2018.
6. Vilalta C, Baker J, Sanhueza J, Murray D, Sponheim A, Alvarez J, Sylvia F, Polson D, Torremorell M, Corzo C, Morrison RB. Effect of litter aggregation and pooling on detection of porcine reproductive and respiratory virus in piglet processing fluids. J Vet Diagn Invest. 2019;31(4):625-628.
관련자료
-
이전
-
다음








