PMWS와 PCV2(써코바이러스) 실험실 결과 해석
작성자 정보
- 닥터스와인 작성
- 작성일
컨텐츠 정보
- 2,966 조회
- 목록
본문
농장을 방문하고 필요에 따라 실험실 검사를 의뢰하게 된다. 보통 기본적으로 PRRS 검사를 가장 많이 하게 되는데 PRRS 이외의 다른 세균이나 바이러스 검사를 의뢰하는 경우가 있다.
그런데 수의사의 판단에 의해 필요한 검사를 하는것이 아니라 농장에서 항목을 지정하고 검사를 요구하는 경우가 종종 있다. 필자의 생각에 보통 검사비용을 농장에서 지불하지 않기 때문에 무조건 이것저것 많은 항목을 검사하는게 좋다고 판단하거나 아니면 잘못된 지식을 가지고 검사 결과를 해석하고 있기 때문에 불필요한 항목들을 요구하는것이 아닌가 하는 생각을 한다.
이번 주제에서는 써코바이러스 실험실 검사결과를 해석할때 오해(항원 또는 항체 양성일 경우 반드시 PCV2 감염에 의한 PMWS인가?)할 수 있는 부분들에 관한 내용들을 공유하고자 한다. 참고로 본 내용은 베링거인겔하임 웨비나(웹 + 세미나)에서 발표한 Statoshi Otake 박사의 강의내용을 기본으로 재구성했다.
1. 질병발생 역학
PCV2와 PMWS(Post-weaning Multisystemic Wasting Syndrome, 이유후 전신소모성 증후군) 관계를 정확히 이해하기 위해서 질병발생 역학 관계를 먼저 소개하겠다.
질병은 숙주, 병원체, 환경 3가지 요소들의 상호작용에 의해 발생한다(그림 1). 따라서 3가지 요소들 중 어느 한가지 요소를 차단하게 되면 질병 전파를 막을 수 있다.
PCV2를 예를들어 보면 바이러스가 농장내 존재하는 상황에서 숙주가 반드시 PCV2에 감염되는것은 아니다. 만약 감염된다고 해도 무조건 질병으로 나타나는것은 아니다.
실험실 검사에서 PCV2가 검출된다고 해서 반드시 농장내 PMWS가 나타나는것은 아니다.

2. PMWS 양성 vs 음성농장의 PCV2 항원, 항체 양성율 비교
* 퀘백지역에서 PMWS 음성 2농장 vs 양성 5농장
각 농장당 3~23주령 돼지를 4주 간격으로 60두씩 채혈하고 혈청을 가지고 PCV2와 PRRSV 항체 그리고 PCV2, PRRSV, PPV(파보) PCR 항원 검사를 진행했다.
A농장(PMWS 유)과 P농장(PMWS 무)의 일령별 10두씩 PCV2 항원, 항체 비교 검사결과는 다음과 같다(그림 2).
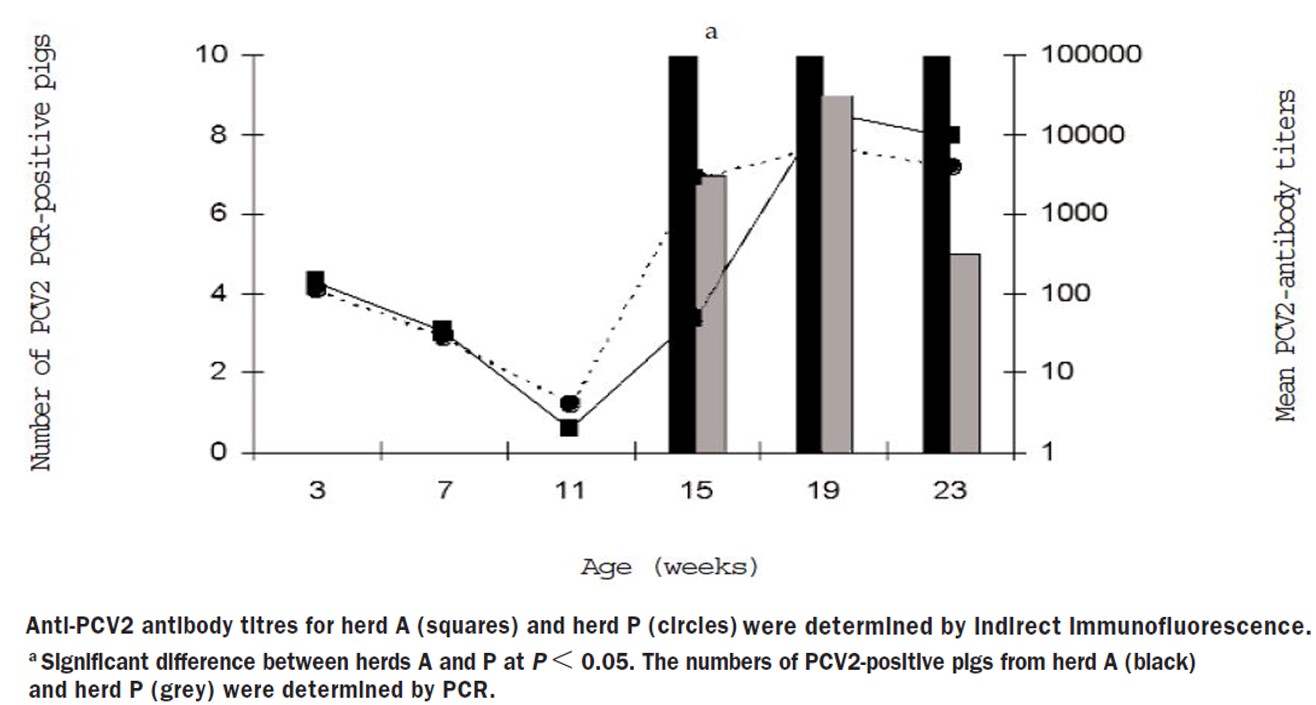
PMWS가 없는 2농장을 포함해서 7농장 중 6농장에서 PCV2의 항체 검사 결과가 매우 유사했다. 3주부터 11주령까지 항체는 점차적으로 감소하고 15주령에 항체양성 전환된 후 모든 돼지에서 높은 PCV2 항체가를 형성했다.
6~7주령에 임상증상이 나타난 1농장을 제외하고 11~15주령에 PCV2 바이러스혈증이 나타났다. PCV2 바이러스혈증은 동일 돼지에서 최소 8주동안 감지되고 바이러스는 23주령 혈청 샘플의 41%에서 여전히 감지됐다.
PMWS가 있거나 없는 농장에서 유사한 항체가를 보였기 때문에 항체수치는 질병의 발생에 영향을 미치지 않는것으로 보여졌다. PMWS가 없는 농장의 PCV2 strain 분석 결과 PMWS가 있는 4개 농장과 상동성이 99.4~100% 일치했다.
* 현재 PMWS 증상이 없는 5농장(과거 2년이내 PMWS 감염) vs PMWS 증상이 있는 4농장
PMWS 양성농장과 음성농장의 돼지에서 PCV2 바이러스혈증과 항체 사이의 연관성을 평가하는 실험을 진행했다.
5농장은 과거 2년이내 PMWS를 경험했지만 실험당시 육성-비육단계의 폐사율이 5% 미만을 유지하고 PMWS 유사한 임상증상이 없는 상태였다. 4농장은 실험당시 PMWS 증상이 존재하는 상황이었다. 후자(4농장)의 경우 과거 PMWS 진단이 있었고 육성-비육단계 초기 성장 지연, 호흡곤란, 청색증 그리고 5~15% 폐사율을 보였다.
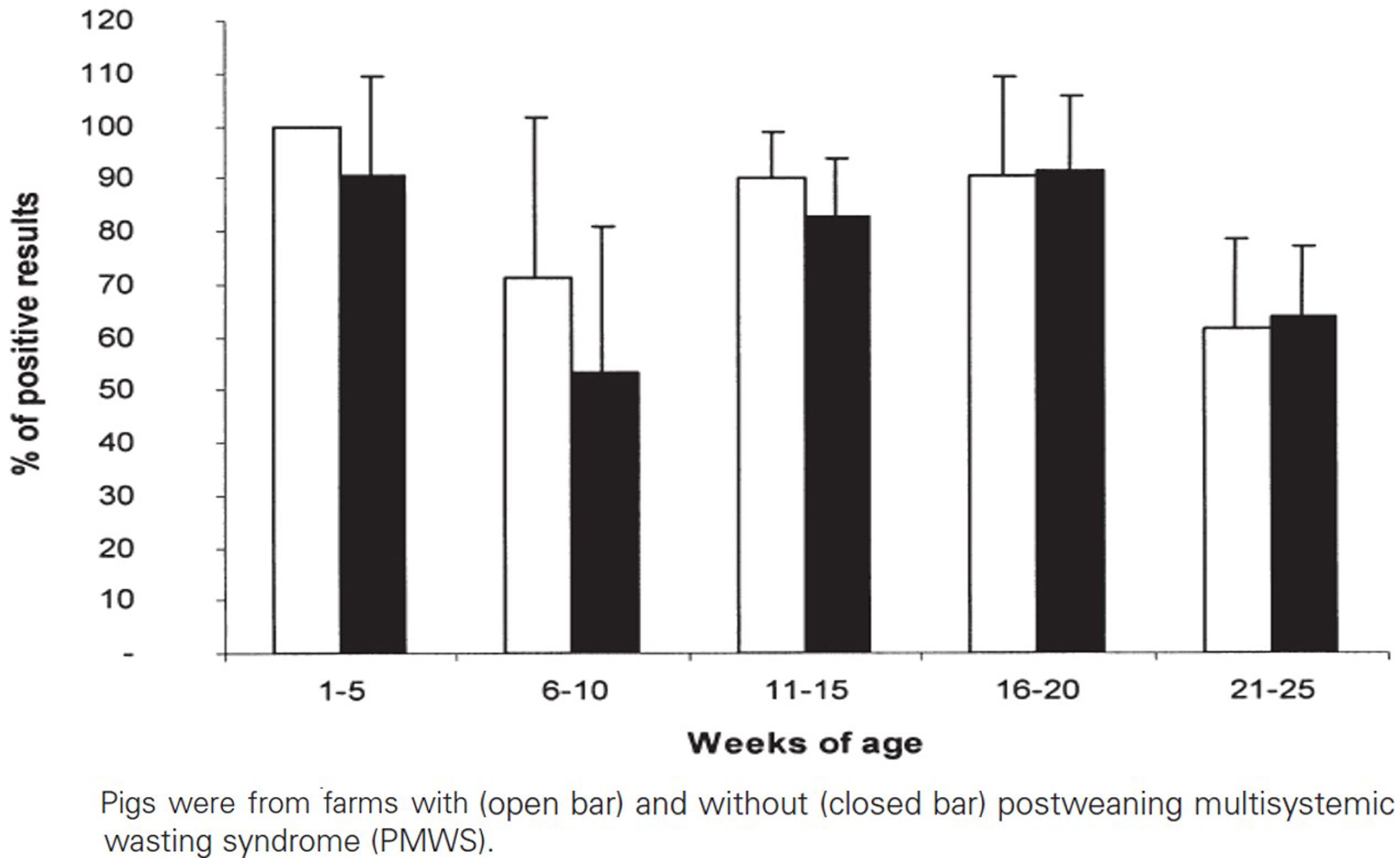
9개 농장에서 1~25주령 사이의 돼지들 비강 스왑과 혈액 샘플을 가지고 항원, 항체 검사를 진행했다. 총 495두 중 236두는 PMWS 양성농장, 259두는 PMWS 음성농장의 돼지였다.
PMWS 양성농장은 191두(81%), 음성농장은 202두(78%) 항체 양성이었다. ELISA(OD > 1.48) 검사를 이용한 항체 양성비율은 PMWS 양성농장에서 약간 높게 나타났지만 PMWS 양성과 음성농장의 혈액 샘플에서 OD값의 차이는 없었다(그림 3).
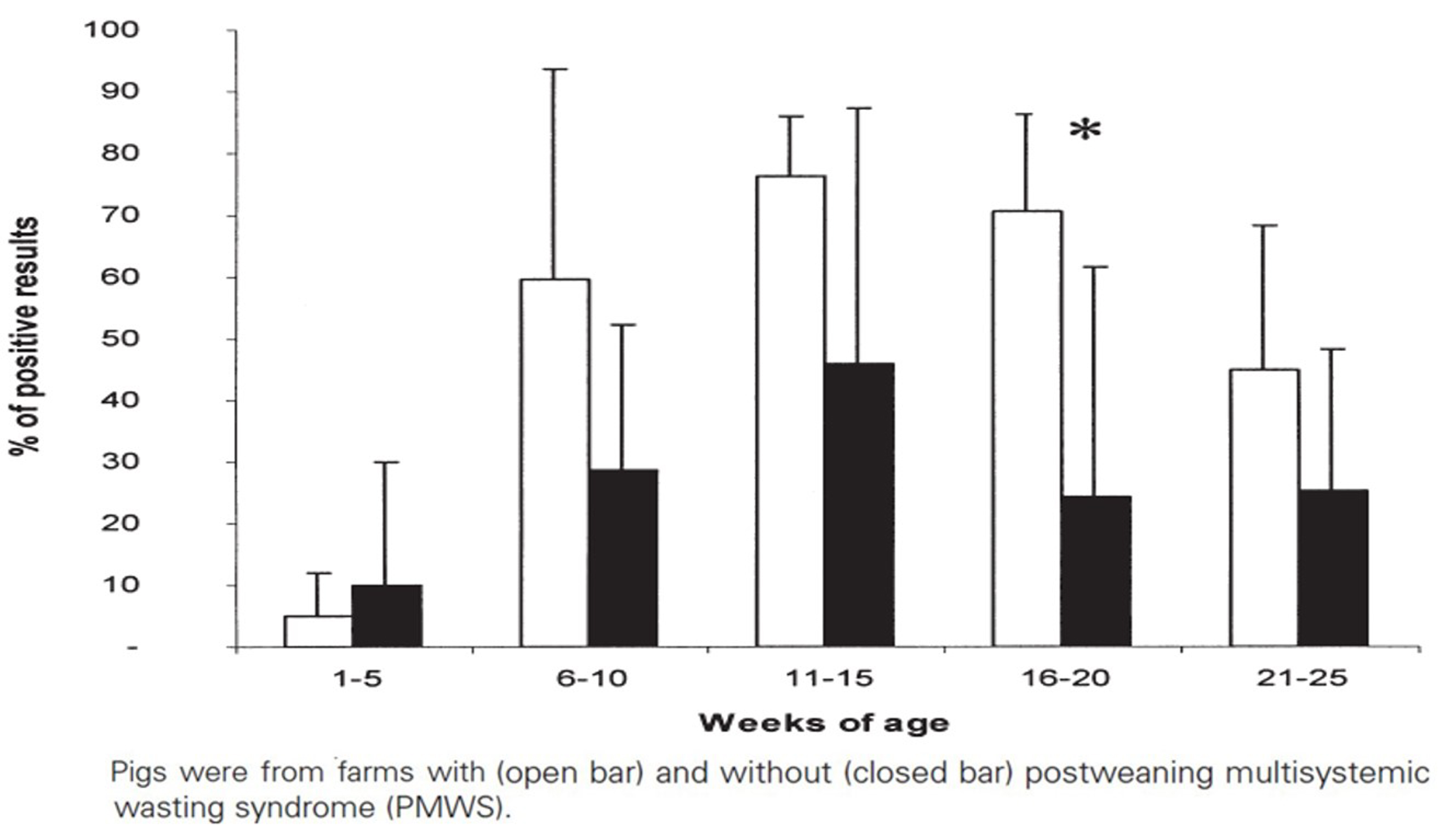
혈액 샘플 PCR 검사결과 PMWS 양성농장은 129두(55%), PMWS 음성농장은 66두(25%) 항원 양성이었다. 두 농장 모두 1~5주령 그룹에서 처음 PCV2 DNA가 진단됐고 11~15주령까지 양성비율이 증가했다가 그이후로 점차 감소했다. 혈액 샘플에서 PCV2 양성 비율은 농장의 PMWS 상태와 관계 없고 16~20주령 그룹에서만 통계적 유의성이 존재했다(그림 4).
* 스페인, 덴마크 11개 농장의 14개 독립배치(각 100~154두)를 대상으로 출생부터 PMWS 발생까지 모니터링
국제적인 평가 기준(EU definition www.pcvd.org/news.php)에 따라 PMWS를 진단하고 돼지상태를 3가지(PMWS 케이스, PMWS는 아닌 소모성 케이스, 건강한 돼지)로 분류 및 혈액 그리고 비강과 직장 스왑 샘플을 이용해서 qPCR 항원검사와 항체 검사를 진행했다.
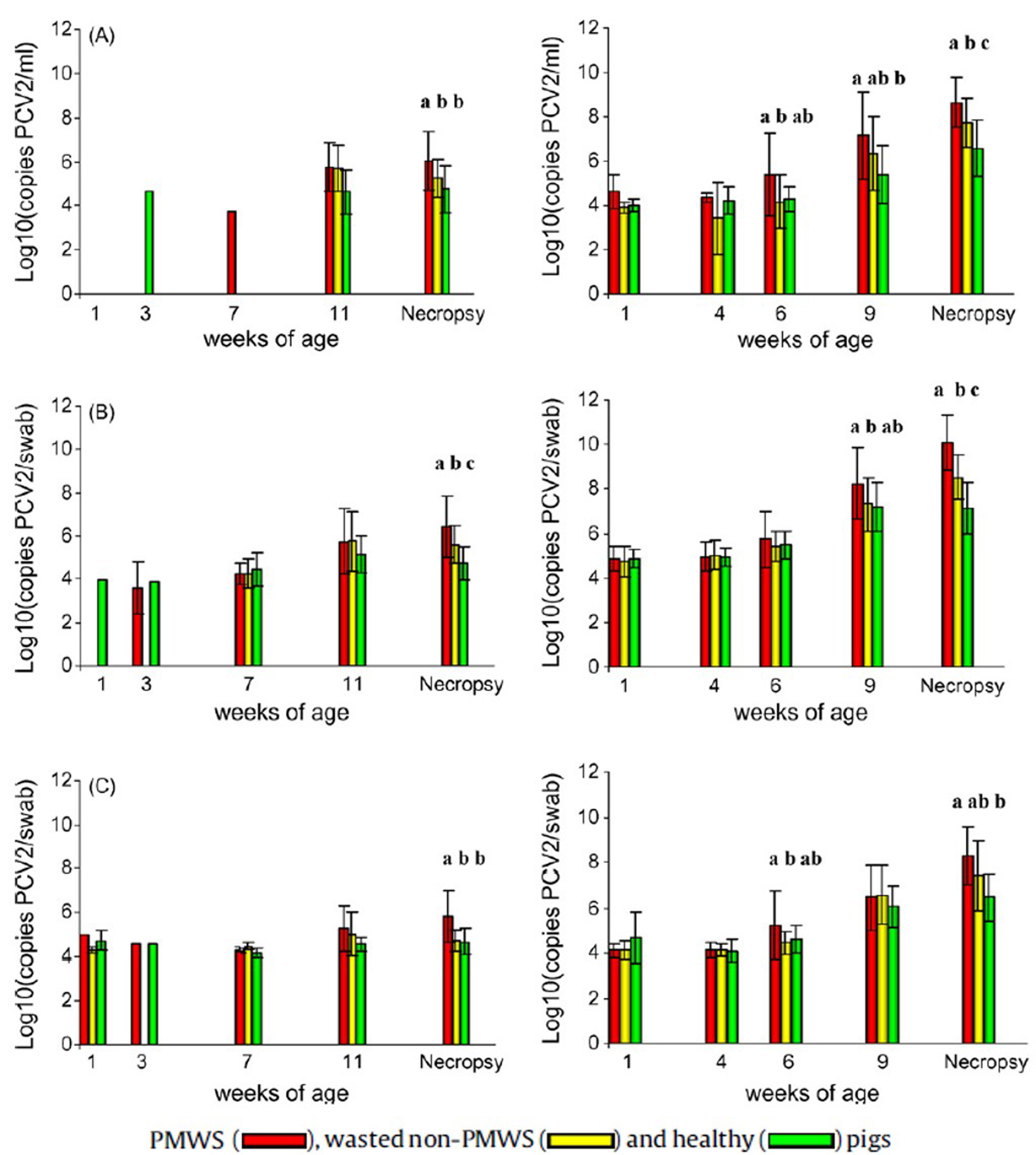
PCV2 항원 검사결과는 다음과 같다(그림 5). PCV2 항원양은 모체이행항체 수치가 감소하면서 증가했고 임상증상이 나타남과 동시에 바이러스양은 최대치에 도달했다.
스페인과 덴마크 모두 부검단계의 PCV2 양성 샘플에서 PMWS 케이스와 건강한 돼지 그룹사이의 PCV2 바이러스양은 상당한 차이가 존재했다(p<0.001).
덴마크의 경우 부검전 혈액(p<0.01)과 비강스왑(p<0.05) 샘플에서 건강한 돼지와 PMWS 케이스의 구별이 가능할 수 있지만 스페인 그렇지 못했다.
PCV2 항체 검사결과는 다음과 같다(그림 6). 스페인과 덴마크 모두 1주령 자돈에서 PCV2 모체이행항체가 존재했고 스페인 건강한 돼지 그룹에서 특히 높게 나타났다(p<0.05). 그러나 3주령과 7주령에서 통계적 유의성은 없었다.
스페인 PMWS 케이스 그룹은 11주령과 부검단계에서 PMWS 미감염 그룹(PMWS는 아닌 소모성 케이스, 건강한 돼지)보다 더 낮은 항체 titer를 기록했다(p<.0.05).
덴마크 건강한 돼지 그룹은 1주령, 4주령, 6주령 3단계에서 PMWS 케이스 그룹보다 통계적으로 상당히 높은 모체이행항체 titer를 기록했다(p<0.05). 그러나 항체양성 전환후 통계적 유의성은 존재하지 않았다.
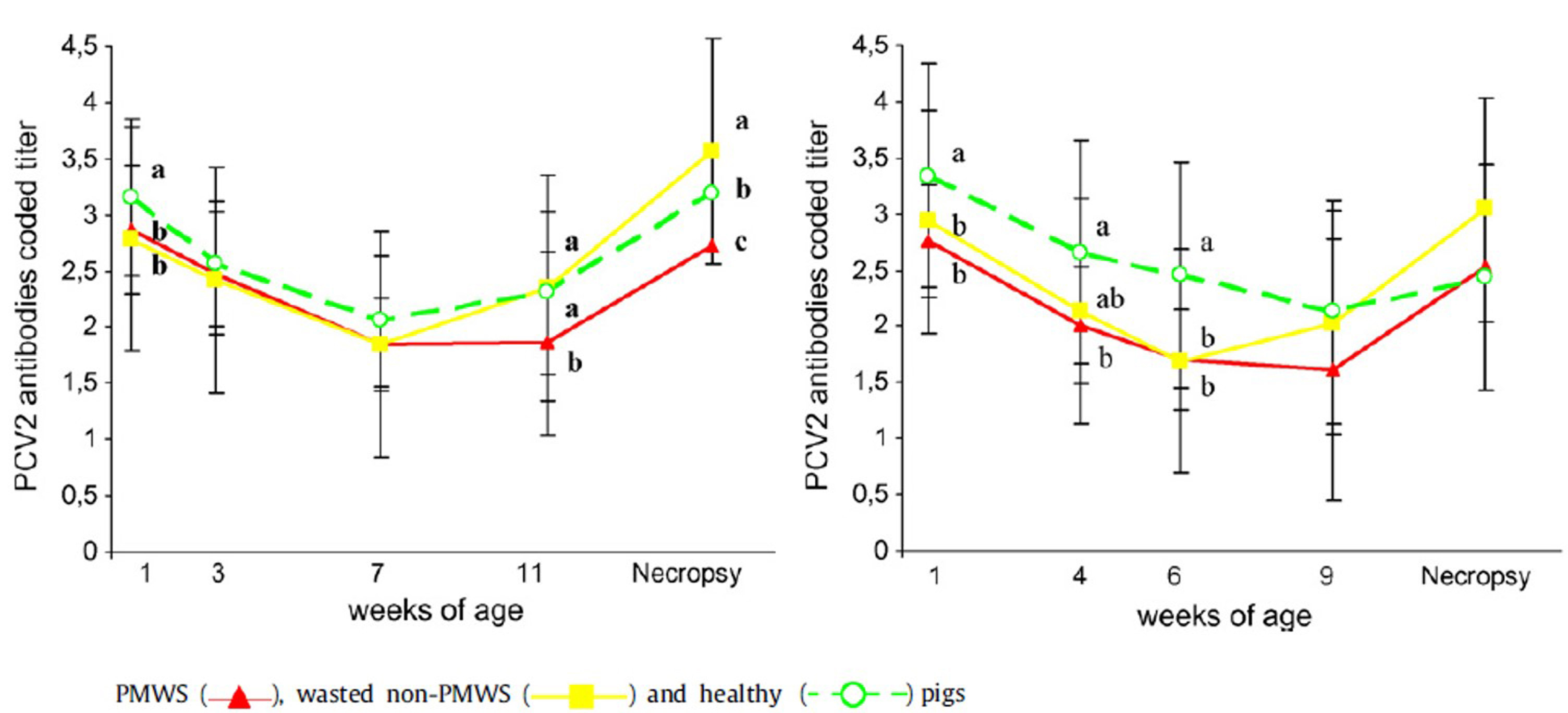
결론적으로 PMWS 진단은 임상적으로 의심되는 돼지의 50%에서만 실험실 검사를 통해 확인됐다. 혈액 그리고 비강과 직장 스왑 샘플을 이용한 qPCR 항원 검사와 항체 검사는 PMWS 감염 농장에서 PMWS 진단을 위한 조직내 PCV2 진단 + 조직병리학검사를 대체할 수 없다.
3. 결과 요약
상업용 PCV2 백신은 PCVAD를 컨트롤 하기위한 매우 효과적인 도구이며 전세계적으로 양돈 농가들 대부분이 백신을 사용하고 있다.
PCV2는 아주 흔한 바이러스이고 돈군내 정상 세균총과 같이 생각할 수 있다. 단독으로 PCV2를 진단했을때 반드시 '질병'을 의미하지는 않는다.
PCV2 바이러스혈증과 혈청검사는 방어할 수 있는 면역과 백신의 효능을 완벽하게 평가할 수 없다.
PCVAD를 정확하게 진단하기 위해서는 경제적인 생산 데이터 분석, 임상증상 그리고 병원체 검사를 진행해야 한다. 또한 PCVAD 컨트롤을 하기 위해서 PRRS 관리와 사양관리가 동시에 진행되어야 한다.
4. 참고 문헌
1. Larochelle R, Magar R, D'Allaire S. Comparative serologic and virologic study of commercial swine herds with and without postweaning multisystemic wasting syndrome. Can J Vet Res. 2003 May;67(2):114-20.
2. Sibila M, Calsamiglia M, Segalés J, Blanchard P, Badiella L, Le Dimna M, Jestin A, Domingo M. Use of a polymerase chain reaction assay and an ELISA to monitor porcine circovirus type 2 infection in pigs from farms with and without postweaning multisystemic wasting syndrome. Am J Vet Res. 2004 Jan;65(1):88-92.
3. Grau-Roma L,*, Hjulsager CK, Sibila M, Kristensen CS, Lo´pez-Soria S, Enøe C, Casal J, Bøtner A, Nofrarı´as M, Bille-Hansen V, Fraile L, Baekbo P, Segale´s J, Larsen LE. Infection, excretion and seroconversion dynamics of porcine circovirus type 2 (PCV2) in pigs from post-weaning multisystemic wasting syndrome (PMWS) affected farms in Spain and Denmark. Veterinary Microbiology 135 (2009) 272–282.
4. Opriessnig, T., McKeown, N.E., Zhou, E.M., Meng, X.J., Halbur, P.G., 2006. Genetic and experimental comparison of porcine circovirus type 2 (PCV2) isolates from cases with and without PCV2-associated lesions provides evidence for differences in virulence. J. Gen. Virol. 87, 2923–2932.
5. Vigre, H., Baekbo, P., Jorsal, S.E., Bille-Hansen, V., Hassing, A.G., Enoe, C., Botner, A., 2005. Spatial and temporal patterns of pig herds diagnosed with Postweaning Multisystemic Wasting Syndrome (PMWS) during the first two years of its occurrence in Denmark. Vet. Microbiol. 110, 17–26.
관련자료
-
이전
-
다음








